本記事は英文ブログを日本語に翻訳再編集(一部追記を含む)したものです。本記事の正式言語は英語であり、その内容・解釈については英語が優先します。
DR. JENNY SHARPE
Senior Scientific Writer, Centre for Innovation in Regulatory Science, Clarivate
Centre for Innovation in Regulatory Science(CIRS)の新しい研究によると、過去20年間の規制の収束にもかかわらず、世界の規制当局間で承認までの時間に依然として差があることが明らかになりました。以下の記事は、最新のCIRS R&Dブリーフィング 「New Drug approvals in six major authorities 2011-2020」から得られた主要な知見をまとめたものです。
欧州医薬品庁(EMA)、米国食品医薬品局(FDA)、日本の独立行政法人医薬品医療機器総合機構(PMDA)、カナダ保健省、スイス医薬品局、オーストラリア治療薬局(TGA)の審査承認時間を分析した結果、3つの大きな傾向が明らかになりました。
1. 規制当局の承認に要する時間はまだ異なる
過去20年間の規制の収束にもかかわらず、本研究では、2020年には6機関の間で承認時間にまだ差があることが示されました(図1)。この差は、他の4機関に比べて欧州の規制当局(EMAおよびスイス医薬品局)で特に顕著でした。
しかし、申請から科学的評価の終了までの期間を比較すると、6機関間でのばらつきは大きくありませんでした(図1のカッコ内の数字)。このことから、少なくとも一部の機関では、科学的評価の終了後に、事務的な活動やスポンサーとの追加的な表示の交渉などの活動が行われていることが明らかになりました。
図1:2011年~2020年における6つの規制当局の新有効成分(NAS)の承認期間の中央値

出典:Centre for Innovation in Regulatory Science Centre for Innovation in Regulatory Science (CIRS)
承認時間は、申請日から当局による承認日までで計算されます。この時間には、機関と企業の時間が含まれます。EMAの承認時間には、EU委員会の時間が含まれています。N1=2020年に承認された製品の承認時間の中央値、(N2)=2020年に承認された製品の提出から科学的評価の終了までの時間の中央値。
2. FDAは最も多くのNASを承認し続けている
今回の調査では、6機関が承認したNASの数は、過去10年間でおおむね増加していることがわかりました。しかし、過去5年間のみを考慮した場合、FDAを除くすべての機関で承認数にプラトーが見られ、引き続き承認数が増加していることがわかりました。これは、FDAで促進されたレギュラトリー・パスウェイが利用できるようになったことや、FDAで承認された医薬品、特に中小企業の医薬品が国際化されないことが原因と考えられます。
3. 作業分担の重要性の高まり
いくつかの規制当局は、規制評価の重複を避け、資源の効率的な利用を促進するために、作業分担のためのフレームワークを開発しているか、開発中です。ワークシェアリングの一環として、関係機関は提出された書類のさまざまな部分をレビューしています。審査は共有されていますが、新薬の承認に関しては各規制当局が独立して判断します。
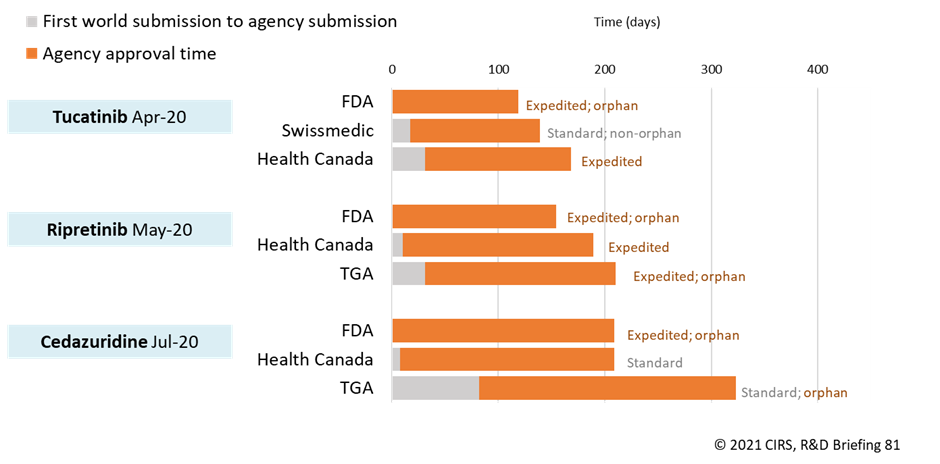
今回のCIRSの調査では、6つの機関の一部を対象とした2つのワークシェアリングの取り組み、Access ConsortiumとProject Orbisの結果を詳しく見てみました。2018年から2020年の間に、7つのNASがアクセスコンソーシアムに参加している機関の1つ以上によって承認されました。2019年の開始以来、Project Orbisは3つのNASの承認を促進しました(図2)。興味深いことに、NASはオーファン指定だけでなく、実施された審査の種類(迅速審査と標準審査)も異なっており、これは迅速審査やオーファン指定を受けるための機関の基準、利用可能なプロセス(カナダ保健省は現在オーファンポリシーを持っていない)、パスウェイや指定を申請するための企業戦略の違いを浮き彫りにしています。
図2:2020年にProject Orbisのメンバーが承認したNASの申請ラグと承認までの時間
出典: Centre for Innovation in Regulatory Science (CIRS)
申請ラグは、最初の規制機関での申請日から対象機関への規制当局への申請日までの時間として計算されます。「迅速審査」とは、カナダ保健省/TGAの「優先審査」とスイス医薬品局の「ファストトラック」を指します。カナダ保健省は現在、オーファンポリシーを設けていません。承認までの期間は、申請日から対象機関の承認日までで計算しています。
COVID-19の影響
COVID-19のようなアンメットニーズのある領域やその他の公衆衛生上の緊急事態に対処するためには、迅速な規制経路やその他の促進された規制経路を利用・活用することが重要です(詳細はCIRS R&D Briefing 75を参照)。2020年、COVID-19治療薬のレムデシビルは、6つの全機関で最も早く承認された抗感染症薬の一つであり、条件付き承認、FDAファストトラック、ローリングレビューの利用など、様々な迅速化・促進化された規制経路が利用されました。
新たな取り組み方法が模索されていますが、COVID-19のパンデミックは、製薬会社と規制当局の双方に大きなプレッシャーを与え続けています(詳細はCIRS R&D Briefing 80を参照)。今後数年間のCIRSの分析では、パンデミックが6つの規制機関によるNASの承認に与えた影響、例えば承認時間の増加や医薬品の国際化の減少などが明らかになるかもしれません。
CIRSでは、2002年から規制当局のベンチマーキングを行っており、同種の比較ができるように規制当局と共同で開発した手法を用いています。2012年から毎年発表されている分析結果は、規制当局のプロセスや実務について独自の洞察を与え、改善すべき点を特定し、企業や規制当局の戦略に役立てられています。
規制に関するより詳しい情報は、ブリーフィング「New drug approvals in six major authorities 2011-2020」をご覧ください。