За последние 10 лет тенденции в создании лекарственных препаратов значительно изменились: теперь в центре внимания оказываются не только профилирующие организации, которые активно занимаются разработкой новых лекарственных средств, но и компании, выступавшие инициаторами программы их разработки. Приведенные данные помогут пролить свет на важные изменения в распределении программ создания новых лекарственных препаратов по странам по сравнению со странами, где активно ведется разработка.
Ниже представлен анализ распределения компаний-разработчиков оригинальных лекарственных препаратов за период с 2011 по 2020 гг. и информация об изменениях, которые произошли за последние 10 лет.
| США | 43,19 % |
| Материковый Китай | 20,24 % |
| Южная Корея | 5,49 % |
| Великобритания | 3,80 % |
| Япония | 3,46 % |
| Канада | 2,86 % |
| Германия | 2,50 % |
| Швейцария | 2,31 % |
| Австралия | 2,00 % |
| Франция | 1,83 % |
Источник: Cortellis Competitive Intelligence™
Как видите, США занимает ведущую позицию: за последние 10 лет на территории страны было разработано 43 % новых лекарственных препаратов. Хотя этот показатель слегка уменьшился за последние 10 лет, он был ниже 40 % только в 2012 году. В Европе1 показатели разработки новых лекарственных препаратов разнились значительнее, в регионе наблюдался более явный спад.
С другой стороны, в материковом Китае последние 10 лет число программ по разработке лекарственных препаратов стабильно растет. В 2011 году в материковом Китае создавалось менее 4 % новых препаратов — меньше, чем в Южной Корее и Японии. Но в 2019 году показатели материкового Китая превысили показатели Европы и теперь превышают 20 % от общего числа программ в регионе.
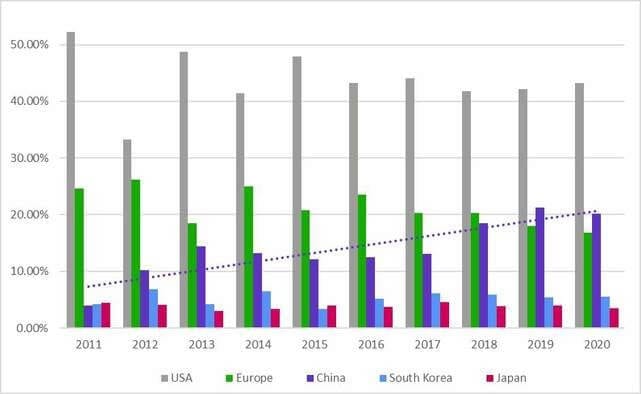
Источник: Cortellis Competitive Intelligence™
Выдающийся рост показателей материкового Китая, вероятно, связан как с увеличением в стране числа открытий в сфере создания новых лекарственных средств, так и с повышенным вниманием со стороны специалистов по международной аналитике и разработке лекарственных препаратов. Китайские власти поддерживали фармацевтическую промышленность и инвестировали 1 млрд юаней (примерно 150 млн долларов США) во время 12-го пятилетнего плана (2010–2015 гг.) и 3 млрд юаней (примерно 450 млн долларов США) во время 13-го пятилетнего плана (2015–2020 гг.). Все средства были направлены на создание «важных новых лекарственных средств». Кроме того, деятельность регулирующих органов стала прозрачнее и ближе к международным стандартам.
Как получилось, что после значительных инвестиций и улучшения в плане соблюдения международных стандартов качества разработки препаратов, продукция китайского производства стала доступной не только на местном рынке, но и на международном?
На сегодняшний день всего четыре лекарственных препарата, произведенных на территории материкового Китая, одобрены Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA).
1.Coartem, фиксированная комбинация артеметера и люмефантрина
Первый в этом списке — препарат Coartem, представляющий собой фиксированную комбинацию артеметера и люмефантрина, зарегистрированный в материковом Китае в 1992 году. Артеметер открыли в 70-х гг.2 в Шанхайском институте Materia Medica (Китайская академия наук) и зарегистрировали в материковом Китае в 1987 году. В то же время в 1970-х гг. в Институте микробиологии и эпидемиологии при Военно-медицинской академии Китая открыли люмефантрин. Исследования в сфере применения новой фармацевтической субстанции совместно с артеметером проводились там же. В 1994 году компания Novartis подписала соглашение о сотрудничестве с целью разработки комбинированного препарата, который в 2009 году был зарегистрирован в США для лечения острой неосложненной малярии. Судя по всему, это первый лекарственный препарат в истории материкового Китая, одобренный FDA США. Он опередил другие аналогичные примеры на целое десятилетие.
2. Brukinsa (занубрутиниб), препарат второй линии терапии мантийноклеточной лимфомы
Вторым препаратом стал Brukinsa (занубрутиниб), предназначенный для лечения мантийноклеточной лимфомы и одобренный FDA США в ноябре 2019 г. По всей видимости, это первый пример одобрения FDA инновационного препарата (новое химическое соединение или новое биологически активное соединение), который был открыт и разработан китайской компанией (BeiGene).
3. Левамлодипина малеат, препарат для лечения артериальной гипертензии
Всего месяц спустя, в декабре 2019 г., FDA одобрило левамлодипина малеат для лечения артериальной гипертензии, ставший уже третьим препаратом в списке. Лекарственное средство разработано китайской компанией CSPC Pharmaceuticals и представляет собой очищенный S-амлодипина малеат, фармакологически активный энантомер амлодипина. Амлодипин был разработан компанией Pfizer и впервые поступил в продажу в Великобритании в 1989 году. Теперь многочисленные дженерики доступны по всему миру, и ведутся исследования нескольких вариантов комбинированной терапии и энантиомерно чистых версий амлодипина.
4. Этесевимаб
Четвертым препаратом из материкового Китая, одобренным FDA, стал этесевимаб. Его открыли в Институте микробиологии при Китайской академии наук, разработкой занималась компания Junshi Biosciences (Шанхай). В мае 2020 г. было подписано соглашение между компаниями Junshi и Eli Lilly о совместной разработке, производстве и дистрибуции этесевимаба за пределами материкового Китая. В феврале 2021 г. FDA США выдало экстренное разрешение на применение этесевимаба и бамланивимаба (последний был открыт канадской компанией AbCellera и разработан совместно с компанией Eli Lilly) для лечения пациентов с коронавирусом COVID-19 умеренной или средней степени тяжести с угрозой прогрессирования заболевания до тяжелой степени и (или) госпитализации.
Перспективный препарат: Rykindo
Один из препаратов, созданных на территории материкового Китая и достойных внимания, — Rykindo, рисперидон в форме микросфер для приготовления раствора для внутримышечного введения с пролонгированным высвобождением. Препарат разработан компанией Luye Pharma (Яньтай). Скорее всего, Rykindo станет первым китайским препаратом, который получит одобрение FDA для лечения шизофрении. Согласно прогнозу Cortellis Drug Timeline & Success Rates от 24 марта 2021 г., препарат получит окончательное одобрение на территории США. В качестве наиболее вероятной даты называют 3 апреля 2021 года. Заявление на регистрацию нового лекарственного средства (NDA) было размещено в BioWorld3 еще в 2019 г. Это первый пример такого заявления в FDA США, исходящего от китайской фармацевтической компании.
Анализ и его результаты открывают широкие возможности для развития бизнеса и сотрудников, в обязанности которых входит подбор кандидатов для портфолио. Кроме того, такая информация позволяет выявить программы, которые с наибольшей вероятностью ждет коммерческий успех. Очень важно следить за новыми программами, появляющимися в условиях стремительно меняющейся экономики: это позволяет выявлять новые источники программ по разработке препаратов.
Будьте на шаг впереди конкурентов и принимайте самые важные решения по формирования портфолио совместно с Cortellis Competitive Intelligence.
Познакомьтесь со всеми основными решениями Cortellis и загрузите дополнительные материалы на странице Решения Cortellis для всего цикла разработки лекарств.
[1] — в рамках данного анализа под Европой понимаются только те страны, которые полностью находятся на территории этой части света, т. е. за исключением России и Турции.
[2] — Chapter 6, Artemisinin and Derivatives: Clinical Studies. In: Guoqiao L, Ying L, Zelin L, Meiyi Z. (eds.) Artemisinin-Based and Other Antimalarials. Academic Press; 2018. pp. 353–413.
[3] — Mak, E. Luye files FDA NDA for China-developed Rykindo. BioWorld. 3 апреля 2019 г. Доступно по ссылке: https://www.bioworld.com/articles/374640-luye-files-fda-nda-for-china-developed-rykindo, доступ — 25 марта 2021 г.




